细胞骨架的动态组装在神经系统发育和信号转导中发挥关键作用。作为听觉神经系统重要的机械感受元件,静纤毛(stereocilia)是耳毛细胞(haircell)顶端特化的富含F-actin的毛状结构,在机械力电转导(mechanoelectrical transduction, MET)过程中发挥了重要作用。成熟的静纤毛呈三层阶梯状排列,较低两层的静纤毛顶端具有机械力门控离子通道(图1)。声波(机械振动)使较低层的静纤毛向较高层位移,较低层顶端的离子通道打开,产生生物电信号,进一步通过神经纤维传递给中枢神经系统,从而产生听觉。因此,静纤毛的细胞骨架动态组装以及阶梯状排布发育过程是听觉产生的基础。
研究表明,静纤毛顶端的电子致密区(Tipcomplex density,TCD)在静纤毛发育中发挥关键功能。TCD富含大量蛋白质,如Whirlin、Eps8、Eps8L2、Myo15、Gpsm2、Gαi等,这些蛋白形成相互作用网络,调控静纤毛的发育。编码这些蛋白的基因缺失会导致小鼠静纤毛顶端TCD的分布分散且不规则并伴随着F-actinbundle的减少,静纤毛形态异常,听力受损。然而,静纤毛发育中的许多关键科学问题仍有待解决,如静纤毛阶梯状排布的分子机制是什么?各层静纤毛的形态特征(如高度、直径等)的内在决定因子是什么?
近日,中国科学技术大学生命科学与医学部王朝教授课题组与上海交通大学Bio-X研究院朱金伟教授课题组合作在ScienceAdvances杂志在线发表题为Promotion of row 1–specific tip complex condensates by Gpsm2-Gαi provides insights into row identity of the tallest stereocilia的研究论文,揭示了特异定位于第一层静纤毛顶端的Gpsm2-Gαi复合物定义最高层静纤毛特征的分子机制,为阐明静纤毛阶梯状排布的内在机理提供了基础。
近年研究表明,静纤毛阶梯状发育机制与平面细胞极性(planarcellpolarity)信号通路密切相关。细胞极性相关Gpsm2-Gαi复合物在发育过程特异定位于第一层静纤毛顶端,在定义最高层静纤毛过程发挥作用,但分子机制不明。研究团队首先研究了Gpsm2-Gαi复合物介导的蛋白相互作用网络的分子机制,揭示了Gpsm2-Whirlin复合物的详细相互作用机理和三维结构基础(图1)。研究发现Whirlin通过一段保守的多肽序列GBD(Gpsm2 binding domain)结合Gpsm2的TPR结构域(图1)。
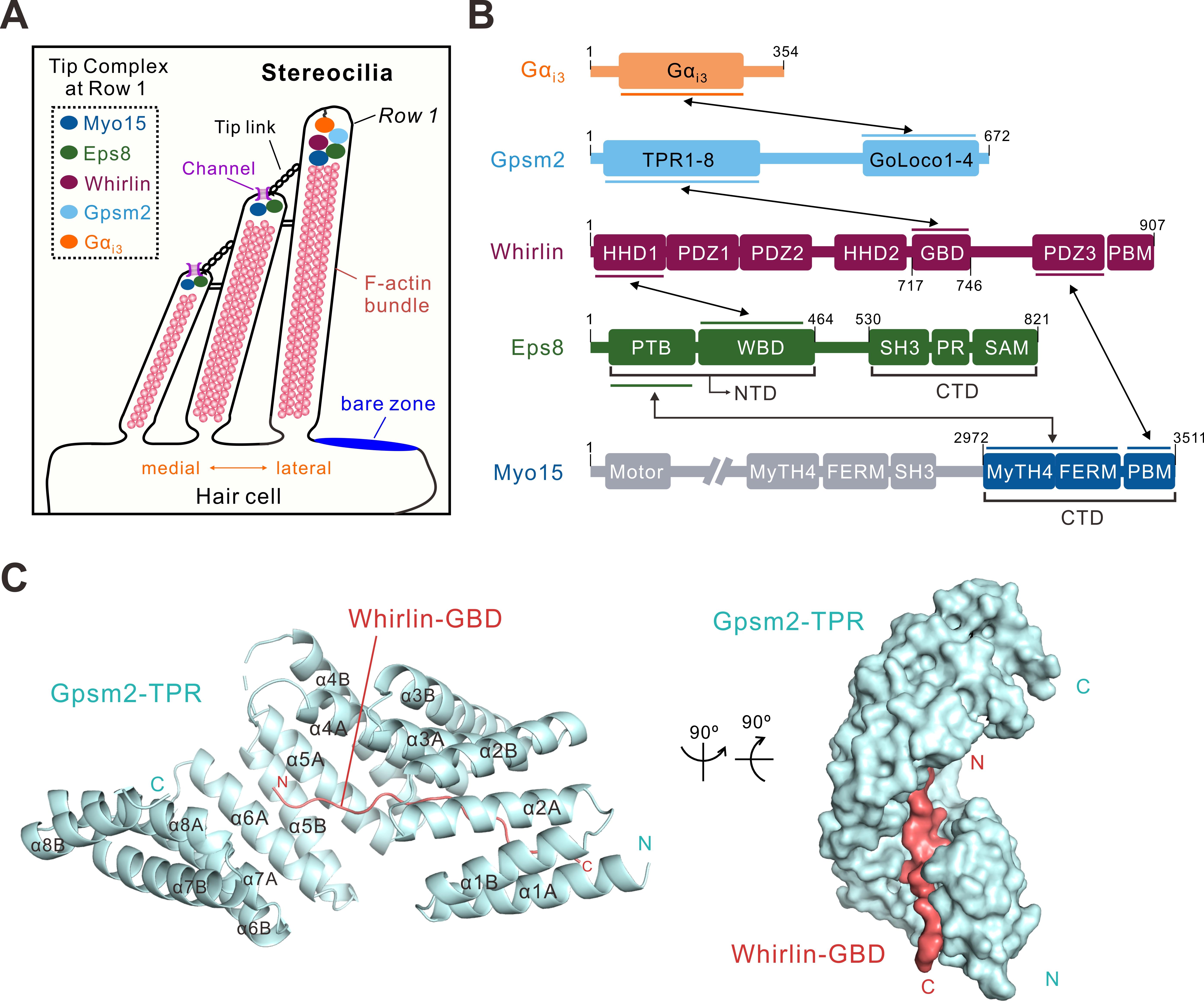
图1. Gpsm2-Whirlin复合物的三维结构
有趣的是,团队研究发现Gpsm2在细胞内及体外均能自发形成液-液相分离(liquid-liquid phase separation)。进一步研究发现,Gpsm2的TPR结构域和GoLoco结构域之间的富含Lys残基的loop区域(poly-Kloop)对其相分离形成至关重要。鉴于团队前期的工作中发现Whirlin-Eps8-Myo15复合物也能够形成相分离介导的凝聚体,团队发现Gpsm2形成的凝聚体能够与Whirlin-Eps8-Myo15凝聚体融合(图2)。
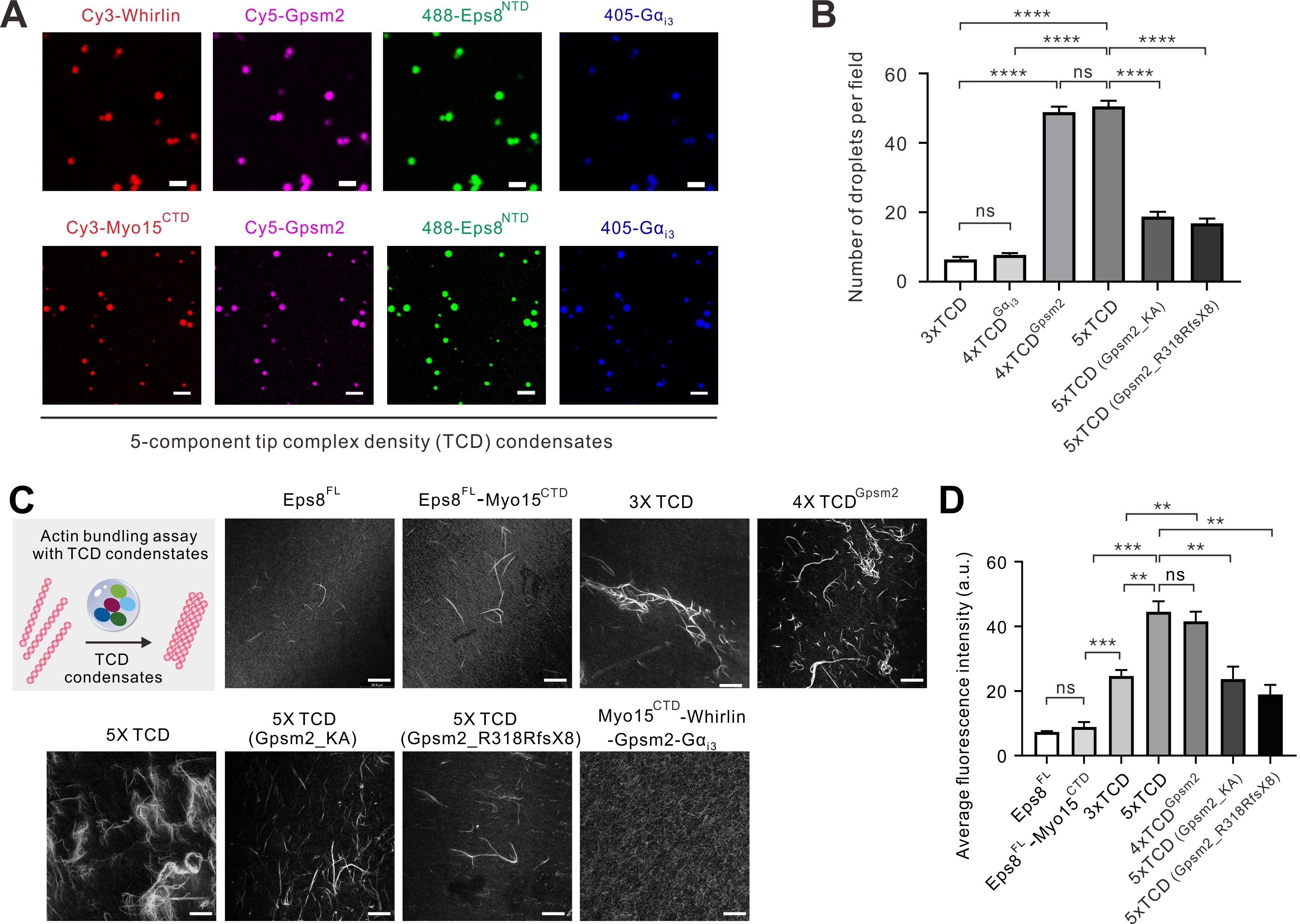
图2.五元复合物TCD凝聚体具有更强的促进F-actin成束能力
更为重要的是,Gpsm2可以通过自身相分离进一步促进Myo15a-Eps8-Whirlin-Gpsm2-Gαi五元TCD凝聚体的形成(图2)。研究团队通过体外F-actin交联实验证实,五元TCD相较于三元TCD(Whirlin-Eps8-Myo15)具有更强的F-actinbundling活性,提示特异定位于第一层静纤毛顶端的Gpsm2-Gαi可能通过进一步促进顶端致密区蛋白复合物的相分离来促进第一层顶端TCD凝聚体组装,从而富集更多的细胞骨架调节因子(包括但不仅限于Eps8和Myo15等)使第一层静纤毛的F-actin细胞骨架比较低层静纤毛(不含有Gpsm2-Gαi)发育得更高,最终定义第一层静纤毛为最高层静纤毛。最后,团队发现在Chudley-McCullough综合征患者中筛查到的疾病突变Gpsm2_R318RfsX8通过影响五元TCD的组装减弱其F-actinbundling的能力,导致患者耳毛细胞中静纤毛发育异常,从而为Chudley-McCullough综合征提供了可能的发病机制(图2)。
综上,本项研究综合利用分子生物学、生物化学、细胞生物学及结构生物学方法,阐释了Gpsm2-Gαi定义最高层静纤毛特征的分子机制,为未来听力损失相关患者的诊疗提供了潜在的新思路(图3)。
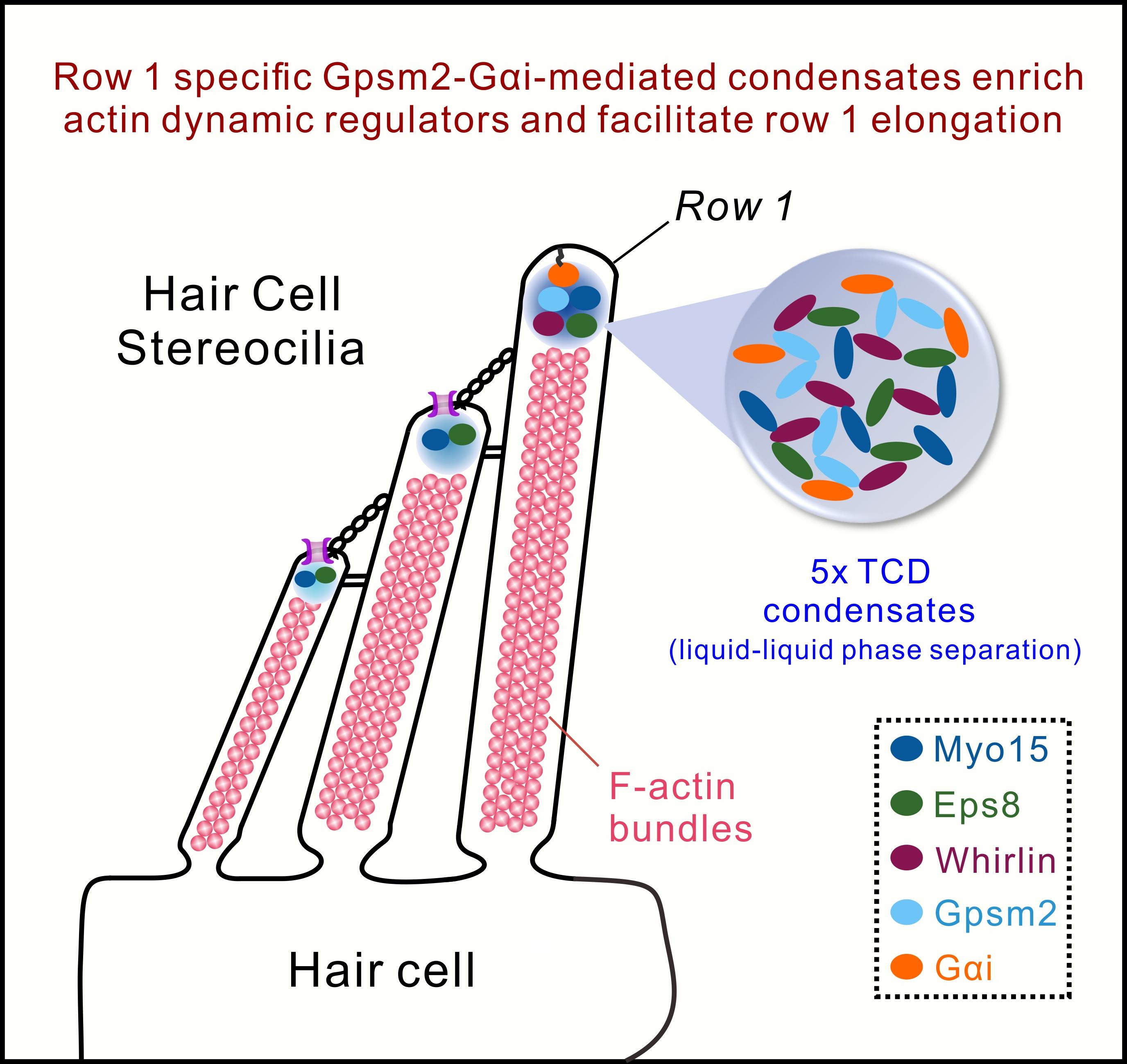
图3.最高层特异定位的Gpsm2-Gαi通过促进顶端凝聚体形成介导静纤毛细胞骨架发育
中国科学技术大学博士研究生时英东与上海交通大学助理研究员林霖为该论文的共同第一作者,王朝教授与朱金伟教授为论文的共同通讯作者,中国科学技术大学为第一完成单位。该研究工作获得了细胞动力学教育部重点实验室、中科大双一流学科建设经费、微尺度国家研究中心、中科院、国家自然科学基金委和科技部等项目支持。
原文链接:https://www.science.org/doi/10.1126/sciadv.abn4556
(细胞动力学教育部重点实验室、微尺度国家研究中心、生命科学与医学部、科研部)
