在自然选择与进化过程中,很多动植物(如蛇,蝎,海葵等)获得了生产毒液的能力,作为它们捕食或者自卫的手段。毒液中的多肽毒素能够特异性作用于离子通道,细胞膜表面受体等与生命活动密切相关的蛋白质。毒素与靶标蛋白相互作用所具有的高特异性和高亲和力的优势使得毒素被作为分子工具,用来研究蛋白的结构与生理功能,并被开发成为治疗疾病的药物。
2012年,法国研究人员从黑曼巴蛇毒液中分离出来两种多肽物质“Mambalgins”,可以让老鼠止住疼痛。进一步的研究发现,Mambalgin能够有效地抑制中枢神经系统和初级疼痛感受器中的酸敏感离子通道(Acid-Sensing Ion Channel,ASIC)活性,阻断神经通路中与疼痛有关的信号,从而达到止痛的效果。Mambalgin的止痛效果和吗啡相当,副作用更小,因此具有药物开发价值。
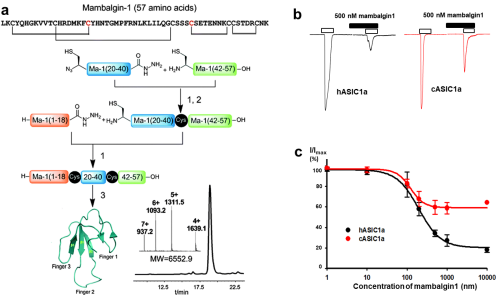
2014年,田长麟实验室运用蛋白质化学合成技术成功制备了具有生物活性的Mambalgin1毒素,并应用液体NMR方法解析了Mambalgin毒素的溶液结构。但是,Mambalgin毒素如何特异性识别以及抑制人源ASIC通道活性(该毒素对人源,鸡源ASIC通道的抑制有明显差异)的作用机制亟待研究。
2020年9月11日,中国科学技术大学田长麟课题组与清华大学刘磊课题组合作,应用冷冻电镜技术解析了首个人源酸敏感离子通道hASIC1a,以及hASIC1a与Mambalgin1复合物的冷冻电镜结构,并综合应用19F-NMR,膜片钳电生理功能分析等技术,揭示了毒素多肽结合并抑制hASIC1a离子通道的结构机制。该工作以 “Structural Insights into Human Acid-sensing Ion Channel 1a Inhibition by Snake Toxin Mambalgin1”为题发表在eLife杂志上(https://elifesciences.org/articles/57096)。
hASIC1a/Mambalgin1复合物结构表明该毒素多肽通过静电相互作用及疏水作用结合在hASIC1a蛋白胞外结构域的外侧,修正了前人对于该毒素与ASIC通道相互作用方式的假说。进一步研究表明,Mambalgin1选择性结合处于关闭状态的ASIC通道,并将离子通道锁定在关闭构像。即便质子浓度升高,通道也难以转换至开放状态。据此,作者提出了Mambalgin1毒素通过一种状态锁定(closed-state trapping)机制实现抑制ASIC通道活性。这一新机制的提出,将为靶向hASIC1a的创新多肽药物开发提供有价值的线索。
研究还发现来人源ASIC通道(hASIC1a)与来源于鸡的ASIC通道(cASIC1)在整体结构上高度相似,但是hASIC1a与cASIC1特定位点上氨基酸的差异导致Mambalgin1分别对hASIC1a或cASIC1的抑制效果差异,揭示了Mambalgin1毒素多肽对不同物种间的调节作用效果差异的物理化学基础。

本工作由中国科学技术大学生命学院特任副研究员孙德猛,刘三玲,博士研究生李思宇,张梦鸽等共同完成。田长麟教授,张隆华副教授,清华大学刘磊教授共同指导本项工作,并作为本文的共同通讯作者。冷冻电镜数据收集在中国科学技术大学集成影像中心和浙江大学冷冻电镜中心完成。本研究工作得到了国家自然科学基金,科技部重大研究计划,科学院先导专项等经费支持。
(合肥微尺度物质科学国家研究中心、生命科学与医学部、科研部)
